La curiosidad es la chispa inicial que despierta el interés por explorar, investigar y hacer preguntas sobre el mundo que nos rodea. Sin esa chispa, sería difícil aventurarse a descubrir cosas nuevas. A lo largo de la historia, la curiosidad llevó a grandes científicos a desafiar lo conocido y preestablecido, a explorar lo ignoto, a aventurarse a plantear todo tipo de hipótesis insospechadas y conjeturas insólitas, a imaginar nuevos y mejores mundos y a construir poco a poco el conocimiento a partir de la observación sistemática, la experimentación rigurosa y el desarrollo de modelos, teorías y leyes.
Una de las características más especiales, poderosas y distintivas de la ciencia es su carácter predictivo. Esto quiere decir que, bajo ciertas condiciones iniciales conocidas, se puede anticipar un fenómeno particular, lo cual es de gran interés en muchos ámbitos del quehacer humano, desde el movimiento de los planetas alrededor del Sol, predicho por la física clásica, hasta el diseño, a partir de la secuenciación genómica, de tratamientos personalizados para tratar con anticipación tal o cual enfermedad.
Una de las características más especiales, poderosas y distintivas de la ciencia es su carácter predictivo.
Históricamente, la física con los asombrosos hoyos negros y las paradojas del tiempo y del espacio, y la biología con la fabulosa doble hélice del ácido desoxirribonucleico (ADN) o el ambicioso Proyecto del Genoma Humano, han gozado de mucha más popularidad que la química, lo cierto es que a la química se le conoce como la ciencia central y, a decir verdad, es una ciencia genial.
Según la Real Academia Española, la química es la ciencia que estudia la estructura, las propiedades y las transformaciones de los cuerpos a partir de su composición. Ahora bien, ¿por qué se le considera la ciencia central? Por su estrecha relación con numerosas disciplinas científicas de las que se nutre, como las matemáticas y la física, y a las que nutre como la biología, la astronomía y la geología, entre otras.
Aunque hoy la química es una ciencia sólida, bien estructurada y con múltiples ramas y áreas del conocimiento, esto no siempre fue así. Hasta hace más o menos 200 años, la química estaba mucho más cerca de la magia, la mística y la espiritualidad, que de las modernas reacciones catalíticas que están presentes en numerosas transformaciones industriales farmacéuticas, o de las máquinas moleculares que se activan por la luz o la temperatura, y llevan a cabo reacciones específicas.
En ese sentido, Antoine de Lavoisier articuló el hito que cambió el rumbo de la química, en el Traité Élémentaire de Chimie, publicado en 1789, mismo año de inicio de la Revolución Francesa. Aunque en este tratado Lavoisier promulgó la ley de la conservación de la materia y rechazó la teoría esotérica del flogisto (según la cual las sustancias inflamables perdían flogisto al cabo de las reacciones de combustión), el texto aborda principalmente la unificación de criterios en torno a cuestiones de nomenclatura y lenguaje químico. Lavoisier definió un elemento como una sustancia que no puede descomponerse en otras más simples por métodos químicos y detalló una lista de los compuestos químicos conocidos en la época y sus nombres.
A la química se le conoce como la ciencia central y, a decir verdad, es una ciencia genial.
En 1860, se celebró el primer congreso internacional de química en la ciudad de Karlsruhe, Alemania. No es casualidad que se abordaran temas de lenguaje y nomenclatura química. Todos los descubrimientos y avances científicos deben ser nombrados y ordenados pues, de otra forma, podrían perderse en un mar de conocimientos demasiado vasto; pero ¿qué se designa exactamente cuando se nombra algo?, ¿por qué se nombra lo que se nombra de una cierta manera y no de otra?, ¿tiene sentido hablar de átomos, elementos y moléculas?, ¿qué representan?, ¿a qué escala? Son preguntas filosóficas que, aunque muy estudiadas, siguen siendo tema de debate y de reflexión entre una parte de la comunidad científica más de 150 años después.
Para poder entender de qué hablamos cuando hablamos de química, es fundamental que hagamos la distinción entre los dos principales niveles que están involucrados. Por un lado están las sustancias macroscópicas, aquellas que podemos ver, tocar, oler, y con las que podemos hacer experimentos en el laboratorio. Estas sustancias están formadas por un número gigantesco de pequeñas partículas iguales.
En el mundo submicroscópico, es decir, en la escala atómica y molecular, se encuentran las entidades químicas, que son las partículas (átomos, iones o moléculas) que juntas forman las sustancias. Las entidades químicas no tienen estado de agregación (esto quiere decir que no son ni líquidas, sólidas o gaseosas), color, olor, punto de fusión o de ebullición, únicamente tienen propiedades geométricas y electrónicas.
Hay otro mundo presente en la química, que es el nivel simbólico, el de los constructos abstractos, de símbolos y palabras, que nos permite relacionar lo macroscópico con lo submicroscópico.
¿Tiene sentido hablar de átomos, elementos y moléculas? ¿Qué representan?
Mientras que una molécula de oxígeno, O2, es una entidad química, la sustancia oxígeno corresponde al gas presente en el aire que nos permite respirar. Un poco de ese gas (la sustancia oxígeno) está formado por un número gigantesco de moléculas de oxígeno… más o menos ¡1023 moléculas de oxígeno! Este número es tan pero tan grande que no existen suficientes estrellas en el Universo para acercársele siquiera. Cuando se dice que en una botella de vino hay 50,000 moléculas, en realidad lo que se está queriendo decir es que hay 50,000 sustancias, cada una de ellas formada por millones de millones de millones de millones de moléculas. ¡Sí, cuatro veces la palabra millones!
En este sentido, los átomos son entidades químicas neutras, es decir, sin carga, formadas por un núcleo que contiene protones y neutrones, y con electrones alrededor del núcleo. Las moléculas también son entidades químicas neutras, formadas por un número finito de enlaces (de 0 a n enlaces, donde n es un número entero finito). Eso quiere decir dos cosas, principalmente: 1. Que un átomo aislado de helio, He, neón, Ne, o argón, Ar, por ejemplo, puede considerarse como una molécula. 2. Que todas las moléculas están formadas por átomos y que el número de átomos es finito. Las moléculas son sistemas químicos puntuales; pueden ser muy grandes y contener muchos átomos, pero si nos diéramos a la tarea, podríamos contar inequívocamente todos sus átomos (ver Figura 1).

Figura 1. Ejemplos de moléculas de oxígeno (O2), octaazufre (S8), helio (He) y fullereno (C60).
Ahora bien, no todas las sustancias están formadas por moléculas, sino por átomos o iones en un arreglo tridimensional conceptualmente infinito. Pero antes, qué es un ion? Es una entidad química cargada, puede ser mono o poliatómico, y de carga positiva (catión) o negativa (anión). El diamante está formado por un número conceptualmente infinito de átomos de carbono en un arreglo específico. De la misma manera, el cloruro de sodio (sal de mesa) no está formado por un catión sodio y un anión cloruro, sino por un arreglo infinito de cationes sodio y aniones cloruro acomodados de una manera específica en una red tridimensional (ver Figura 2). A estas sustancias se les conoce como retículos. Estas entidades (átomos, moléculas y iones) y sustancias (moleculares y reticulares) existen en el mundo concreto, es decir, son objetos químicos que constituyen la materia que nos rodea.
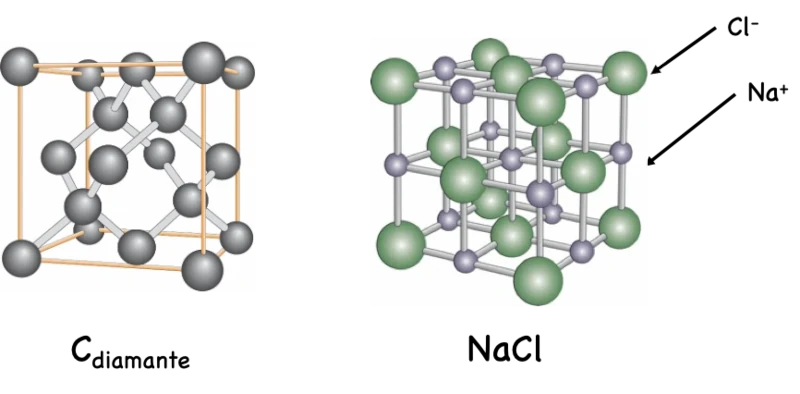
Figura 2. Representación de los retículos del carbono diamante y del cloruro de sodio. Uno debe imaginar que estos cubos se propagan en las tres dimensiones de manera conceptualmente infinita para generar las sustancias correspondientes.
La definición de elemento de Lavoisier fue, sin duda, muy útil en su época. Sin embargo, con los descubrimientos del átomo y de las partículas subatómicas, protones, neutrones y electrones, y el descubrimiento de los isótopos, que son entidades químicas con el mismo número de protones, pero diferente número de neutrones, esta definición dejó de ser válida. Así, un elemento químico es una categoría de núcleos que tiene la misma naturaleza, es decir, con el mismo número de protones.
Cualquier núcleo que tenga 6 protones, pertenece al elemento carbono, sin importar que se trate de un átomo en una molécula (el carbono en el metano CH4), de átomo en un ion (el carbono en el carbonato CO32-), o de un átomo en un retículo (el carbono en el diamante) (ver Figura 3). Un elemento, por lo tanto, no es una partícula ni una sustancia, es una categoría de partículas que tienen en común un cierto número de protones. Para hacer un símil, es como decir que todos los mexicanos pertenecemos a México, pero ninguno de nosotros somos México. México es una categoría, al igual que lo son los elementos químicos.

Figura 3. Carbono diamante, molécula de metano y anión carbonato, todos objetos formados por átomos del elemento carbono.
Como puedes ver, a pesar de que la química como ciencia moderna existe desde finales del siglo XVIII, la terminología sigue debatiéndose y ajustándose a los descubrimientos modernos y a los intereses de los químicos en su afán por comunicar de manera más clara, concisa y práctica, conceptos que son intrínsecamente complejos. ¡Ser químico es fascinante porque, además de hacer numerosos experimentos y saciar la curiosidad con reacciones de todo tipo, se hace constantemente el viaje de ida y vuelta de un mundo que vemos (macroscópico), a uno que no vemos pero imaginamos (submicroscópico) y a otro en el que los símbolos y el lenguaje lo son todo! ¿Te apetece embarcarte en este viaje?









